一、实验目的
1.学习苯甲酸的微波氧化合成方法。
2.掌握制备苯甲酸乙酯的原理和实验方法。
3.掌握分水器的使用,巩固萃取、回流等基本操作。
4.学习半微量有机合成实验操作。
二、基本原理
微波辐射化学是研究在化学中应用微波的一门新兴的前沿交叉学科,它在国外的研究进展十分活跃。自从1986年Gedye等首次报道了微波作为有机反应的热源可以促进有机化学反应以来,微波技术已成为有机化学反应研究的热点之一。与常规加热法相比,微波辐射促进合成方法具有显著的节能、提高反应速率、缩短反应时间、减少污染,且能实现一些常规方法难以实现的反应等优点。
本实验在微波辐射下合成苯甲酸,然后在浓硫酸催化下,苯甲酸和无水乙醇发生酯化反应得到苯甲酸乙酯。
主反应为:
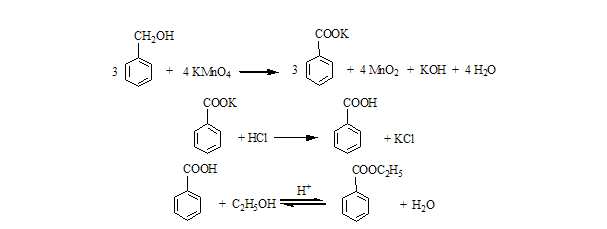
副反应为:
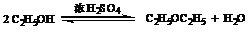
由于酯化反应是一个平衡常数较小的可逆反应,为了提高产率,在实验中采用过量的乙醇,同时利用苯-水共沸物尽可能除去产物中的小分子副产物-水。
合成苯甲酸乙酯的反应机理:
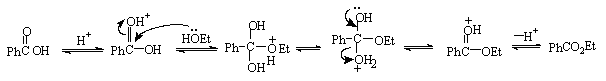
三、主要试剂与仪器
1. 试剂 苯甲醇2.1mL (20 m mol ),高锰酸钾4.2g (26.6 m mol ),无水乙醇2.0mL (34.3 m mol ),碳酸钠2.0g,苯 2.8mL,乙醚10mL,浓硫酸,10%碳酸钠溶液,浓盐酸,无水氯化钙。
2. 仪器 250 mL圆底烧瓶,球形冷凝管,布氏漏斗,吸滤瓶,烧杯,锥形瓶,微型仪器一套(包括15mL、10mL圆底烧瓶,球形冷凝管,分水器,分液漏斗,直形冷凝管,空气冷凝管,蒸馏头,克氏蒸馏头,支管接引管,锥形瓶,量筒,烧杯,毛细管等),微波反应器,红外灯。
四、实验步骤
1. 苯甲酸的制备
在250mL圆底烧瓶中加入依次加入4.2 g高锰酸钾、2.0 g碳酸钠、20mL水,摇匀,再加入2.1mL苯甲醇、30mL水和2粒沸石。将圆底烧瓶置于微波化学反应器内,装上回流装置,关闭微波炉门,设定反应时间为18 min,反应功率为60%(满功率650 W),开启微波反应器。
反应结束后,趁热将反应瓶从微波反应器中取出,迅速抽滤。滤液冷却后,用浓盐酸(约6mL)酸化到pH=3~4,析出固体。抽滤,用少量冷水洗涤,得到苯甲酸粗品。产品用红外灯干燥,用于下一步反应。
2. 苯甲酸乙酯的制备
在15mL干燥的圆底烧瓶中加入干燥的苯甲酸2.0g (16.4mmol )、无水乙醇2.0mL (34.3 m mol )、浓硫酸0.4mL和苯2.8mL,摇匀后加入2粒沸石。装上分水器(在分水器中预先加入适量的水并记下体积),分水器上端安装球形冷凝管。
开始小火加热,让其缓慢回流。反应初期回流速度一定要适当慢一些,随着反应的进行,分水器中逐渐出现上、中、下三层液体。在反应过程中应控制分水器中液面位置,以中层不流回到反应瓶中为准。
回流1.5h后,停止加热,放出中、下层并记下体积。
继续加热以蒸出苯和多余的乙醇,当分水器中的总量达到2.8mL左右时,即可停止加热,并将分水器中液体放出。
烧瓶冷却后,将反应混合物倒入盛有10mL水的烧杯中,分为油层和水层两相。在分液漏斗中分出油层后,水层用5mL ×2乙醚萃取。
合并油层和醚层,依次用2mL10%碳酸钠溶液洗涤(洗涤后检验碱层pH=8~9)、5mL水洗涤,用无水硫酸镁干燥。
将干燥后的苯甲酸乙酯的醚溶液转入10mL圆底烧瓶中,在常压下先小火蒸出乙醚(注意低沸点液体的蒸馏装置),再蒸出没有除尽的苯和乙醇,然后改用减压蒸馏,根据表1数据收集产品。
纯苯甲酸乙酯为无色液体,沸点212.4℃,折射率1.5001,相对密度1.0509,其红外光谱见图2。
五、注意事项
1、制备苯甲酸时,反应结束抽滤后,如滤液呈紫红色,可将滤液放入微波反应器中继续反应2min。
2、制备苯甲酸乙酯时,随着反应的进行,在分水器中会形成三层液体:下层为分水器中原有的水;中层为共沸物的下层,占共沸物总量的16%(含苯4.8%,乙醇52.1%,水43.1%);上层为共沸物的上层,占共沸物总量的84%(含苯86%,乙醇12.7%,水1.3%)。应控制液面位置使得最上层液体始终为薄薄的一层。
3、在制备苯甲酸乙酯回流时,温度不要太高,否则反应瓶中颜色很深,甚至炭化。同样,回流结束后,蒸出苯及多余的乙醇,控制蒸出的总量2.8mL左右时,即可停止加热,不要蒸馏得太久,否则反应瓶中很容易炭化。
六、思考题
1. 本实验采用了什么原理和措施来提高酯化反应的产率?
2. 为什么要用苯来除去反应体系中的水?
3. 比较微波促进反应与常规加热反应、微型实验与常量实验的优缺点。
七、附图表
表1 苯甲酸乙酯的b.p / p数据
|
p(mmHg)
|
1
|
10
|
20
|
30
|
40
|
50
|
60
|
|
b.p(℃)
|
44.0
|
86.0
|
102.5
|
111.3
|
118.2
|
123.7
|
128.5
|
|
p(mmHg)
|
70
|
80
|
90
|
100
|
400
|
760
|
|
|
b.p(℃)
|
132.5
|
136.2
|
139.5
|
143.2
|
188.4
|
212.4
|
|
常量法制备苯甲酸乙酯:
在50mL干燥的圆底烧瓶中加入干燥的苯甲酸5.0g、无水乙醇5.0mL、浓硫酸1.0mL和苯7.0mL,摇匀后加入2粒沸石。装上分水器(在分水器中预先加入适量的水并记下体积,液面离分水器支管口约0.5cm),分水器上端安装球形冷凝管。
开始小火加热,让其缓慢沸腾30min,尽可能不要把乙醇蒸出。
然后,提高温度,加热回流。反应初期回流速度一定要适当慢一些。随着反应的进行,分水器中逐渐出现上、中、下三层液体。在反应过程中应控制分水器中液面位置,上层液体始终是薄薄的一层,中层液面不流回到反应瓶中即可。
回流1.0h后,停止加热,待烧瓶冷却后,将反应混合物倒入盛有25mL水的烧杯中,分为油层和水层两相。在分液漏斗中分出油层后,水层用12mL ×2乙醚萃取。
合并油层和醚层,依次用5mL10%碳酸钠溶液洗涤(洗涤后检验碱层pH=8~9)、10mL水洗涤,用无水硫酸钠干燥。
将干燥后的苯甲酸乙酯的醚溶液转入50mL圆底烧瓶中,在常压下先小火蒸出乙醚(注意低沸点液体的蒸馏装置),再蒸出苯和没有除尽的乙醇,然后改用减压蒸馏,根据表1数据收集产品。
纯苯甲酸乙酯为无色液体,沸点212.4℃,折射率1.5001,相对密度1.0509。
全文点击下载:基础化学实验(Ⅱ)-苯甲酸(微波)与苯甲酸乙酯的制备