一、实验目的
1.学习由醇制备溴代烃的原理及方法。
2.练习回流及有害气体吸收装置的安装与操作。
3.进一步练习液体产品的纯化方法——洗涤、干燥、蒸馏等操作。
二、实验原理
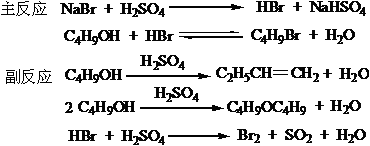
本实验主反应为可逆反应,为了提高产率一方面采用HBr过量;另一方面使用NaBr和H2SO4代替HBr,使HBr边生成边参与反应,这样可提高HBr的利用率,同时H2SO4还起到催化脱水作用。反应中,为防止反应物正丁醇及产物1-溴丁烷逸出反应体系,反应采用回流装置。由于HBr有毒害且HBr气体难以冷凝,为防止HBr逸出,污染环境,需安装气体吸收装置。回流后再进行粗蒸馏,一方面使生成的产品1-溴丁烷分离出来,便于后面的分离提纯操作;另一方面,粗蒸过程可进一步使醇与HBr的反应趋于完全。
粗产品中含有未反应的醇和副反应生成的醚,用浓H2SO4洗涤可将它们除去。因为二者能与浓H2SO4形成佯盐:
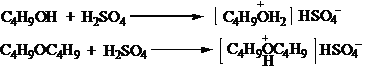
如果1-溴丁烷中含有正丁醇,蒸馏时会形成沸点较低的前馏分(1-溴丁烷和正丁醇的共沸混合物沸点为98.6℃,含1-溴丁烷87%,正丁醇13%),而导致精制品产率降低。
三、实验药品及物理常数
|
药品名称
|
分子量
(mol wt)
|
用 量
(mL、g、mol)
|
熔点
(℃)
|
沸点
(℃)
|
比重
(d420)
|
水溶解度
(g/100mL)
|
|
正丁醇
|
74.12
|
6.2mL(0.068mol)
|
|
117.7
|
0.8098
|
7.9
|
|
1-溴丁烷
|
137.03
|
|
|
101.6
|
1.276
|
不溶于水
|
|
溴化钠
|
102.89
|
8.3(0.08mol)
|
|
77.1
|
0.9005
|
微溶于水
|
|
浓硫酸
|
98
|
10+3 mL
|
|
|
1.84
|
易溶于水
|
|
其它药品
|
10%碳酸钠溶液、无水氯化钙
|
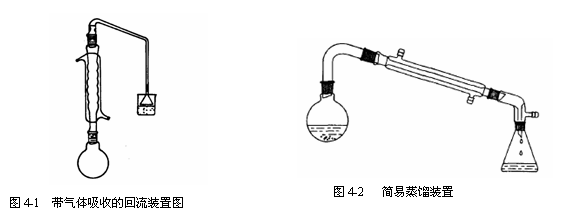
四、实验装置图
制备1-溴丁烷的实验装置如图4-1 ~ 4-2所示。
五、实验流程图
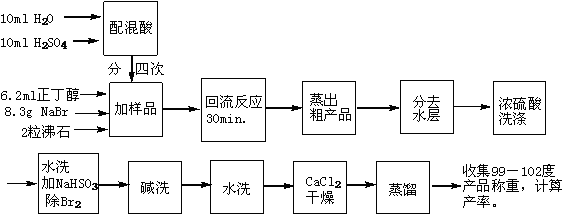
六、实验步骤
1.配制稀硫酸。在烧杯中加入10 mL 水,将10 mL浓硫酸分批加入水中,并振摇。用冷水浴冷却,备用。
2.在100 mL圆底烧瓶中依次加入NaBr 8.3g,正丁醇6.2 mL,沸石2粒,摇匀。
3.安装带气体吸收的回流装置如图4-1,取一温度计套管及一长颈玻璃漏斗,用橡皮管将温度计套管及长颈玻璃漏斗相连,温度计套管装在球形冷凝管上口,长颈玻璃漏斗倒置在一盛有水的烧杯上,使漏斗口接近水面但不要没入水中,以防水倒吸。从冷凝管上口分四次加入配制好的稀硫酸,每次加入稀硫酸后均须摇动反应瓶。
4.加热回流30min。
5.冷却5min后,加沸石2粒,改成简易蒸馏装置如图4-2。
6.加热蒸馏直至无油滴蒸出为止。
7.在分液漏斗中将馏出物静置分层。下层倒入干燥的锥形瓶,加入3mL浓硫酸洗涤,在分液漏斗中静置分层。
8.分出下层(硫酸层),上层用10mL水洗,静置分层。
9.下层用5mL 10%碳酸钠溶液洗,静置分层。
10.下层用10mL水洗,静置分层。
11.下层倒入干燥的锥形瓶中,加无水氯化钙干燥,加塞放置。时时振摇,至澄清透明为止。
12.将干燥好的粗产品1-溴丁烷倒入50 mL圆底烧瓶(注意勿使氯化钙干燥剂掉入烧瓶中),加2粒沸石,装好蒸馏装置如图4-4,用小火加热,收集99~102℃馏分。产品量体积,回收,计算产率。
七、基本操作和注意事项
1、 加热回流
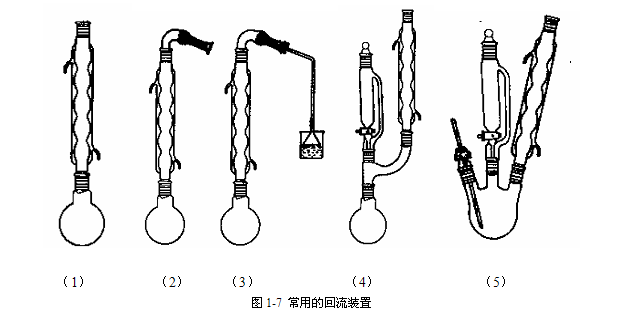
有机反应很多情况下是在溶剂、原料的沸腾温度或较高温度下进行的,为了防止溶剂、原料或产物逸出反应体系引起损失、带来污染及不安全因素,常需要采用回流装置。常用的回流装置如图1-7所示,其中图1-7(1)是一般的回流装置。若需要防潮,则可在冷凝管顶端装一氯化钙干燥管,如图1-7(2)所示。图1-7(3)是用于防潮并吸收有氯化氢、溴化氢或二氧化硫等气体产生和逸出的反应。图1-7(4)是用于一边加料、一边进行回流的装置。图1-7(5)是用于滴加、回流过程中测定反应液温度的装置。
进行回流前,应选择合适的烧瓶,液体体积占烧瓶容积的1/2左右为宜。加热前,先在烧瓶中放入沸石,以防暴沸。回流停止后要再进行加热,必须重新放入沸石。根据瓶内液体的沸腾温度,在140℃以下采用球形冷凝管,高于140℃时应采用空气冷凝管。冷凝水不能开得太大,以免把橡皮管弹掉。加热的方式可根据具体情况选用水浴、油浴、电热套和石棉网直接加热等。实验过程中应注意回流速度的控制,通常以每秒1至2滴为宜,或者仔细观察蒸汽的高度,蒸汽高度通常以不超过冷凝管的1/3高度为宜,否则因来不及冷凝,会在冷凝管中造成液泛,而导致液体冲出冷凝管。
2、 有害气体吸收
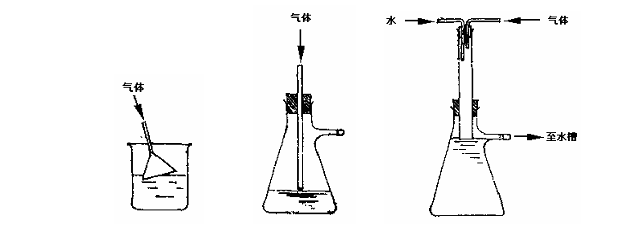
在某些有机化学实验中会产生和逸出有刺激性的、水溶性的气体(例如,在制对甲苯乙酮时会产生大量氯化氢,在制正溴丁烷时会逸出溴化氢),这时,必须使用气体吸收装置来吸收这些气体,以免污染实验室空气。常见的气体吸收装置见图1-6 ,其中图1-6(1)和图1-6(2)是用于吸收少量气体的装置。图1-6(1)中的漏斗口应略为倾斜,使一半在水中,一半露出水面,这样既能防止气体逸出,又可防止水被倒吸至反应瓶中。图1-6(2)的玻璃管应略微离开水面,以防倒吸。有时为了使卤化氢、二氧化硫等气体能较完全地被吸收,可在水中加少些氢氧化钠。若反应过程中会生成或逸出大量有害气体,特别当气体逸出速度很快时,应使用图1-6(3)的装置。在图1-6(3)中,水自上端流下(可利用冷凝管流出的水),并在恒定的平面上从吸滤瓶支管溢出,引入水槽。粗玻璃管应恰好伸入水面,被水封住,吸收效果较好。
(1) (2) (3)
图1-6 常见的气体吸收装置
3、 加料时,不要让溴化钠粘附在液面以上的烧瓶壁上,加完物料后要充分摇匀,防止硫酸局部过浓,一加热就会产生氧化副反应,使产品颜色加深。
4、 加热时,一开始不要加热过猛,否则,反应生成的HBr来不及反应就会逸出,另外反应混合物的颜色也会很快变深。操作情况良好时,油层仅呈浅黄色,冷凝管顶端应无明显的HBr逸出。
5、 如果用磨口仪器,粗蒸时,也可将75°弯管换成蒸馏头进行蒸馏,用温度计观察蒸气出口的温度,当蒸气温度持续上升到105℃以上而馏出液增加甚慢时即可停止蒸馏,这样判断蒸馏终点比观察馏出液有无油滴更为方便准确。用浓硫酸洗涤粗产品时,一定要事先将油层与水层彻底分开,否则浓硫酸被稀释而降低洗涤的效果。如果粗蒸时蒸出的HBr洗涤前未分离除尽,加入浓硫酸后就被氧化生成Br2,而使油层和酸层都变为橙黄色或橙红色。
6、 步骤6蒸出1-溴丁烷完全与否可从以下三方面判断:(1) 蒸馏瓶内上层油层有否蒸完。(2) 蒸出的液体是否由混浊变澄清。(3) 用盛清水的烧杯收集馏出液,有无油滴沉在下面。
7、 酸洗后,如果油层有颜色,是由于氧化生成的Br2造成的,在随后水洗时,可加入少量NaHSO3,充分振摇而除去。
8、 本实验最后蒸馏收集99-102℃的馏分,但是,由于干燥时间较短,水一般不能完全除尽,因此,水和产品形成的共沸物会在99℃以前就被蒸出来,这称为前馏分,不能做为产品收集,要另用瓶接收,等到99℃后,再用事先称重的干燥的锥形瓶接收产品。
八、问题研究与讨论
1、 硫酸的浓度 制备1-溴丁烷通常采用NaBr-H2SO4法。过去曾用68.2%的H2SO4(20mL浓硫酸+15mL水),加热回流时有大量的HBr气体从冷凝管顶端逸出生成酸雾。如果降低硫酸的浓度,可使逸出的HBr气体大大减少。实验发现,如果采用62.2%的H2SO4(10mL浓硫酸+10mL水),加热回流时,基本上没有HBr气体从冷凝管顶端逸出。因此,本实验采用后种方法。但是,如果操作马虎,或加料不准确,或加热太剧烈,仍会产生酸雾。为了避免产生酸雾,减轻实验室的空气污染,对初学者还是要求安装气体吸收装置。
2、 回流时间 为了探讨最佳的反应时间,做了以下实验:用5g正丁醇,8.3g溴化钠10mL浓硫酸加10mL水,加热回流一定时间后,用分液漏斗分出油层,用10%碳酸钠溶液洗涤,再用水洗涤,无水氯化钙干燥,所得粗品做气相色谱分析,结果见表8-1。
表8-1 回流反应时间对正溴丁烷产量的影响
|
回流时间/min
|
粗产物中正丁醇含量/%
|
1-溴丁烷的产量/g
|
|
10
30
50
|
4.99
2.19
1.44
|
5.0
6.5
6.5
|
由实验结果可以看出,回流30min后,反应已基本完成,再增加反应时间,1-溴丁烷的含量并没增加,因此,最佳反应时间为30min。
3、 副产物正丁醚 用气相色谱分析发现粗产物中含有正丁醚,而且不论回流时间长短,正丁醚的含量都是0.2%-0.5%。将62.2%的硫酸用量增加一倍,粗产物中正丁醚的含量仍然相同。
4、 浓硫酸洗涤的效果 实验发现7mL粗产物用1mL浓硫酸洗涤后,所含的正丁醇几乎全部除去。如用1mL浓盐酸洗涤,则尚有少量正丁醇残留,需用3-5mL浓盐酸才能将正丁醇除尽。本实验采用3mL浓硫酸洗涤,完全可以除去粗产物中的正丁醇和正丁醚。
九、教学方法
1、 这个实验包括加热回流、蒸馏、洗涤、干燥等步骤,操作方法较齐全,现象明显,容易解释,也便于提问和引导学生思考。实验容易成功,初学者只要认真操作,按教材上的小量规模实验,产量一般可达5g 以上。在课时不多,实验个数较少的课程中,适合于安排为第一个制备实验。预习和准备工作做得较好的学生,4小时就可从容地完成本实验。
2、 在条件许可时,可以组织几个学生为一组做这个实验,分别采用不同条件(如不同的回流时间,不同的硫酸浓度和用量等),互相比较,一同总结实验的结果。
3、 在实验课时较多的课程中,可以让学生做选做实验或文献实验,用不同的醇(如异丙醇、仲丁醇、异戊醇等)制备溴代烷。用异丁醇为原料时,产物中有近一半不是预期的异丁基溴,可以引导学生去思考产生这个异常现象的原因。同样还可以用3-甲基-2-丁醇(旋光性戊醇)做原料,考察反应的产物。
十、思考题及参考答案:
1. 溴丁烷制备实验为什么用回流反应装置?
答:此反应较慢,需要在较高的温度下、长时间反应,而玻璃反应装置可达到的最高反应温度是回流温度,所以采用回流反应装置。
2. 溴丁烷制备实验为什么用球型而不用直型冷凝管做回流冷凝管?
答:因为球型冷凝管冷凝面积大,各处截面积不同,冷凝物易回流下来。
3. 溴丁烷制备实验采用1﹕1的硫酸有什么好处?
答:减少硫酸的氧化性,减少有机物碳化;水的存在增加HBr溶解量,不易逃出反应体系,减少HBr损失和环境污染。
4. 什么时候用气体吸收装置?怎样选择吸收剂?
答:有污染环境的气体放出时或产物为气体时,常用气体吸收装置。吸收剂应该是价格便宜、本身不污染环境,对被吸收的气体有大的溶解度。如果气体为产物,吸收剂还应容易与产物分离。
5. 1—溴丁烷制备实验中,加入浓硫酸到粗产物中的目的是什么?
答:除去粗产物中未反应的原料丁醇或溶解的副产物丁烯等。
6. 1—溴丁烷制备实验中,粗产物用75度弯管连接冷凝管和蒸馏瓶进行蒸馏,能否改成一般蒸馏装置进行粗蒸馏?这时如何控制蒸馏终点?
答:可用一般蒸馏装置进行粗蒸馏,馏出物的温度达到100℃时,即为蒸馏的终点,因为1-溴丁烷/水共沸点低于100℃,而粗产物中有大量水,只要共沸物都蒸出后即可停止蒸馏。
7. 在1—溴丁烷制备实验中,硫酸浓度太高或太低会带来什么结果?
答:硫酸浓度太高:
(1)会使NaBr氧化成Br2,而Br2不是亲核试剂。
2 NaBr + 3 H2SO4(浓) →Br2 + SO2 + 2 H2O +2 NaHSO4
(2)加热回流时可能有大量HBr气体从冷凝管顶端逸出形成酸雾。
硫酸浓度太低:生成的HBr量不足,使反应难以进行。
全文点击下载:基础化学实验(Ⅱ)- 1-溴丁烷的制备