一、实验目的
1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理
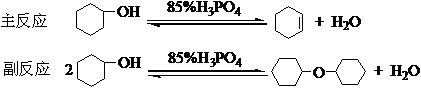
主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过73℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。
三、实验药品及物理常数
|
药品名称
|
分子量
(mol wt)
|
用 量
(mL、g、mol)
|
熔点
(℃)
|
沸点
(℃)
|
比重
(d420)
|
水溶解度
(g/100mL)
|
|
环己醇
|
100.16
|
10mL(0.096mol)
|
25.2
|
161
|
0.9624
|
稍溶于水
|
|
85%H3PO4
|
98
|
5mL(0.08mol)
|
|
|
1.834
|
易溶于水
|
|
环己烯
|
82.14
|
|
|
83
|
0.8098
|
不溶于水
|
|
其它药品
|
饱和食盐水、无水氯化钙
|
四、实验装置图

图1 反应装置 图2 蒸馏装置 图3 分液漏斗
五、实验流程图
六、实验步骤
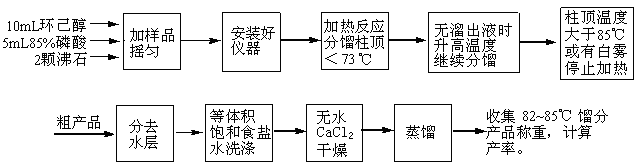
在50毫升干燥的圆底烧瓶中,放入10mL环己醇(9.6g,0.096mol)、5mL85%磷酸,充分振摇、混合均匀。投入2粒沸石,按图1安装反应装置,用锥形瓶作接受器。
将烧瓶慢慢加热,控制加热速度使分馏柱上端的温度不要超过73℃,馏出液为带水的混合物。当没有溜出液时,升高温度,继续分馏。当温度计读数超过85℃,或烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。全部蒸馏时间约需40min。
将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤微量的酸,产品在哪一层?)。将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入无水氯化钙干燥。
将干燥后的产物滤入干燥的50mL圆底烧瓶中,加入2粒沸石,加热蒸馏,收集82~85℃的馏分,产量约4~5g。
本实验约需4h。
七、操作要点及注意事项
1、本反应是可逆的,故采用了在反应过程中将产物的反应体系分离出来的办法,推动反应向正反应方向移动,提高产物的产率。
2、环己醇在常温下是粘稠状液体,因而若用量筒量取时应注意转移中的损失。所以,取样时,最好先取环己醇,后取磷酸。
3、磷酸有一定的氧化性,加磷酸后要充分摇勺后加热,否则在加热过程中可能会局部碳化,使溶液变黑。
4、由于反应中环己烯与水形成共沸物(沸点70.8℃,含水l0%);环己醇也能与水形成共沸物(沸点97.8℃,含水80%)。因比在加热时温度不可过高,蒸馏速度不宜太快,以减少未作用的环己醇蒸出。(实验要求柱顶控制在73℃左右,但反应速度太慢。本实验为了加快蒸出的速度,可控制在85℃以下。
5、反应终点的判断可参考以下几个参数:(1)反应进行40min左右;(2)分馏出的环己烯和水的共沸物达到理论计算量;(3)反应烧瓶中出现白雾;(4)柱顶温度下降后又升到85℃以上。
6、液体物质的干燥通常是通过向带有少量水的液体中加入干燥剂,振荡并密封放置而干燥的。就每一类被干燥物选择干燥剂时,其基本原则是干燥剂不能与被干燥的物质起化学反应,干燥剂也不能溶解在被干燥的物质里。
当干燥未知物质的溶液时,一定要使用化学惰性的干燥剂,譬如硫酸镁或硫酸钠。金属钠在使用时,可用压钠机将金属钠压成丝状直接加到被干燥的液体物质中。金属钠块在放入到压钠机前,其氧化表皮应予除去。压钠机使用后,必须用乙醇处理,再用水洗净干燥待用。
在干燥液体物质或溶液的过程中,并不是干燥剂加得越多越好。实际上,干燥效能的高低取决于干燥剂吸水后结晶水水合物的蒸汽压的大小,蒸汽压越小干燥效能越高。所以,当已经达到化学平衡,加入多余的干燥剂只能造成液体物质的损失。
在实际操作中,应当将被干燥的液体中的水分尽可能分离干净,不应有任何可见的水层。将该液体置于锥形瓶中,用药勺取适量的干燥剂放入液体中,加塞振摇片刻。如发现干燥剂附着瓶壁互相粘结,表明干燥剂不够,应予添加。一般每10毫升液体约需0.5~1克干燥剂。经干燥后,液体由浑浊变澄清,表明液体中的水分已基本除去。
洗涤分水时,水层应尽可能分离完全,否则将增加无水氯化钙的用量,使产物更多地被干燥剂吸附而招致损失。这里用无水氯化钙干燥较适合,因它还可除去少量环己醇。无水氯化钙的用量视粗产品中的含水量而定,一般干燥时间应在半个小时以上,最好干燥过夜。但由于时间关系,实际实验过程中,可能干燥时间不够,这样在最后蒸馏时,可能会有较多的前馏分(环己烯和水的共沸物)蒸出。
7、萃取与洗涤的原理与操作都相同,所不同的是它们的目的不一样。洗涤常用于在有机物中除去少量酸、碱等杂质。这时一般可以用稀碱或稀酸水溶液来反洗有机溶液,通过中和反应以达到除去杂质的目的。在洗涤或萃取时,当溶液呈碱性时,常常会产生乳化现象。这时可以通过静置、加入少量食盐、加入少量稀硫酸等方法来破坏乳化。
萃取的具体操作如下:
首先选择容积较被萃取溶液体积大一倍以上的分液漏斗,将漏斗活塞取出擦干后薄薄地涂上一层凡士林,塞好活塞后旋转数圈,然后放置在铁圈中(铁圈固定在铁架上);再关闭活塞,将被萃取溶液和萃取剂(一般为被萃取溶液体积的1/3)依次自上口到入到分液漏斗中,塞好上端玻塞或橡皮塞;取下分液漏斗以右手手掌顶住漏斗磨口玻璃塞,手指握住漏斗的颈部,左手握住漏斗的活塞部分,大拇指和食指按住活塞柄,中指垫在塞座下边,然后振摇;振摇时将漏斗略倾斜,漏斗的活塞部分向上,便于自活塞放气;开始时振摇要慢,每摇几次以后,就要将活塞打开放气,如此反复放气到漏斗中的压力较小时,再剧烈振摇2-3分钟,然后将漏斗放回到铁圈中静置;待两层液体完全分开后,打开上面的玻塞,在将活塞缓缓旋开,下层液体自活塞放出;再从分液漏斗的上口倒出上层液体;水层再倒入漏斗,重复上述萃取操作即可。
8、在蒸馏已干燥的产物时,蒸馏所用仪器都应充分干燥。接收产品的锥形瓶应事先称重。
9、进实验室前,一定要事先查好原料、产品及副产品的物理常数,做到心中有数。
八、思考题
1、 在纯化环己烯时,用等体积的饱和食盐水洗涤,而不用水洗涤,目的何在?
答:在纯化有机物时,常用饱和食盐水洗涤,而不用水直接洗涤是利用其盐析效应,可降低有机物在水中的溶解度,并能加快水、油的分层。
2、 本实验提高产率的措施是什么?
答:本实验主反应为可逆反应,提高反应采取的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物,并控制柱顶温度不超过85℃。
3、 实验中,为什么要控制柱顶温度不超过85℃?
答:由于环己烯和水形成的二元共沸物(含水10%)沸点是70.8℃,而原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过85℃。
4、 本实验用磷酸作催化剂比用硫酸作催化剂好在哪里?
答:采用硫酸作催化剂虽然反应速度较快,但由于硫酸的氧化性比磷酸强,反应时部分原料会被氧化、甚至碳化,使溶液颜色加深,产率有所降低。此外,反应时会有少量SO2气化放出。在纯化时,需要碱洗,增加了纯化步骤。
5、蒸馏时,加入沸石的目的是什么?
答:沸石就是未上釉的瓷片敲碎而成的小粒。它上面有很多毛细孔,当液体加热时,能产生细小的气泡,成为沸腾中心。这样可以防止液体加热时产生过热现象,防止暴沸,使沸腾保持平稳。
一般加热回流、蒸馏、分馏、水蒸汽发生器产生水蒸汽都需要加沸石。但减压蒸馏、水蒸气蒸馏、电动搅拌反应不需要加沸石。
在一次持续蒸馏时,沸石一直有效;一旦中途停止沸腾或蒸馏,原有沸石即失效,再次加热蒸馏时,应补加新沸石。如果事先忘了加沸石,决不能在液体加热到沸腾时补加。因为这样会引起剧烈暴沸,使液体冲出瓶外,还容易发生着火事故。故应该在冷却一段时间后再补加。
6、使用分液漏斗有哪些注意事项?
答:使用分液漏斗洗涤和萃取时,有以下注意事项:
(1)分液漏斗在长期放置时,为防止盖子的旋塞粘接在一起,一般都衬有一层纸。使用前,要先去掉衬纸,检查盖子和旋塞是否漏水。如果漏水,应涂凡士林后,再检验,直到不漏才能用。涂凡士林时,应在旋塞上涂薄薄一层,插上旋转几周;但孔的周围不能涂,以免堵塞孔洞。
(2)萃取时要充分振摇,注意正确的操作姿势和方法。
(3)振摇时,往往会有气体产生,要及时放气。
(4)分液时,下层液体应从旋塞放出,上层液体应从上口倒出。
(5)分液时,先把顶上的盖子打开,或旋转盖子,使盖子上的凹缝或小孔对准漏斗上口颈部的小孔,以便与大气相通。
(6)在萃取和分液时,上下两层液体都应该保留到实验完毕,以防止操作失误时,能够补救。
(7)分液漏斗用毕,要洗净,将盖子和旋塞分别用纸条衬好。
7、用无水氯化钙干燥有哪些注意事项?
答:(1)一般要在干燥的小锥形瓶中进行干燥。(2)一般用块状的无水氯化钙进行干燥,便于后面的分离。(3)用无水氯化钙干燥的时间一般要在半个小时以上,并不时摇动。但实际实验中,由于时间关系,只能干燥5~10分钟。因此,水是没有除净的,在最后蒸馏时,会有较多的前馏分(环己烯和水的共沸物)蒸出。
8、查药品物理常数的途径有哪些?
答:在进行或设计一个有机合成实验之前,必须首先弄清楚反应物料和生成物的物理常数,这样在反应、分离纯化时,才能设计出合理的工艺路线,操作时才能做到心中有数。通常查找物理常数有四个途径:
(1)在教材书中,每一章的物理性质都列出了一些常见化合物的物理常数。另外,在多数实验教材书的附表中,也列有一些常见溶剂和物料物理常数。
(2)在图书馆中,查阅相关的手册。主要查阅有机化合物手册、有机合成手册、化学手册、物理化学手册等。
(3)在网上查找,有些网站和化学品电子手册专门提供物理常数。
(4)在实验室的试剂瓶上,一般都列有主要物理性质的常数。
全文点击下载:基础化学实验(Ⅱ)- 环己烯的制备